ここでは医薬品の開発プロセスについて解説します。
医薬品は様々な試験や課題をパスして初めて医薬品として承認されます。そのため、開発には多くの人材・職種が複雑に絡み合っています。
薬の一生を大きく分けると、①創薬研究、②医薬品開発、③販売・育薬となっています。
このカラムでは③販売・育薬の部分について解説します。
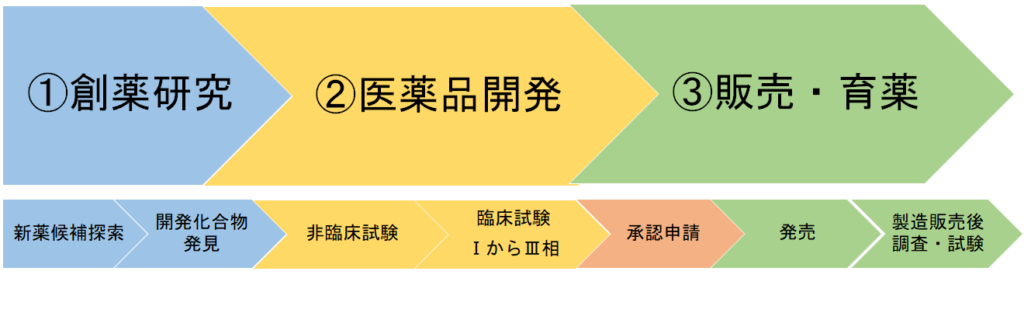
③販売・育薬
製造販売承認が降り、晴れて医薬品が誕生しました。社会に求められる医薬品がようやく市場に流通します。
販売、供給
医薬品が承認されたため、増産し全国に供給します。
ここからは医薬品というプロダクトをどのように宣伝・情報共有し、どのように製品を供給していくかが使命となります。
また並行して、承認申請時の治験データとはごく限られた一部のデータである側面もあり、市場に出て使用者が爆増した段階で見えてくる不都合などがあるかもしれません。したがって安全性のモニタリングは承認後の発売以降にも継続して実施されます。
MR:Medical Representative(医薬情報担当者)
製薬会社などに所属する営業部隊です。
主な役目は大きく2つ
・自社の医薬品の有用性や情報を伝え普及させること
・医療現場で使用した際に発生した副作用情報の収集
MRは直接的な営業活動ですが、通常の営業職と異なるのは販売に関する直接の交渉(価格交渉)をしない点です。
医薬品はそもそも薬価が指定されており、医療機関は定価で医薬品卸業からの購入となります。
医療期間側が値段交渉をする場合は医薬品卸との交渉となるからです。
MRは薬の有用性を説明することに集中し、医療現場での採用を推進することが最大の役割と言えます。
お付き合いを重視した営業職の側面が無いとも言えませんが、新薬の意義を真摯に伝えること、理解を得ることが重要な仕事です。
また新薬の効果や副作用について医療現場からの情報を収集します。これらの情報は、開発企業にとって大変重要であるため、大切な仕事の一つとなっています。(GVP管理体制の一翼を担っています。)
これまで、MRは製薬会社に所属していることが通常。
しかし近年は、製薬会社からMR業務を請け負うCSO(Contract Sales Organization)が台頭し、コントラクトMRと呼ばれる派遣型外注のMRが増加しています。
これも人件費削減、会社の経営コストの削減の象徴といえます。
MRの他の役割として、これから出る新薬の売り込みがあります。
既存治療法との差異などを説明し、医療現場へ最新の情報を届ける役目も担っています。
しかし、近年で様々問題が発生しています。
新薬の紹介は次代の収益につながる重要な作業なのですが、その手法に大きな問題があるのです。
医療関係者に対する情報提供 ≒ 広告
大変悩ましい活動と思えますが、薬機法上では第66~68条において規定がなされています。
ざっくりポイントと、その違反事例について記載しますと、
- 効果の保証、取得した効能以外の効果があるような説明 → 自社品が優位に見える恣意的なグラフの使用、副作用の曲解説明
- 未承認医薬品の広告 → 予定される新薬といえど承認前は該当。営業的に苦しい部分ともいえる。
大きく以上の2点が問題視されていました。
近年ではこうした対策チームの発足や、実態確認として医療従事者が不当な案内をされた場合は、覆面警察としてその事実を通報する形の調査が行われた程です。
これらは”広告”としては完全アウトな行為です。
情報提供の前提としてある程度黙認されていた部分ですが、近年は目に余る恣意的な情報提供事例が多発したため、
薬機法改正にて規制が強化されるに至りました。
MRさんの気持ちもわからなくないですが…。
医療用医薬品の広告の在り方の見直しに関する提言
厚労省HPより
- 平成 26 年度厚生労働科学研究班会議・最終とりまとめ -
製薬企業の薬事コンプライアンスに関する研究班
厚生労働省 医薬・生活衛生局 監視指導・麻薬対策課委託事業
厚労省HPより
医療用医薬品の広告活動監視モニター事業 報告書
MRを取り巻く環境が変化している最中ですが、MRは薬剤師の適正が高い職業だと思っています。
医療従事者とのディスカッション機会も多いことから、同じ水準の知識・素養があることは重要です。
加えて、医療経済や倫理観のバランス感覚を武器とできる薬剤師なら、スマートな案内ができたのではないかなと推察してしまいます。

PMS:Post Marketing Surveillance(市販後調査・製造販売後調査)
PMSとは医薬品や医療機器の販売後に行われる、品質や有効性、安全性の確保を図るための調査のことです。
すでに承認されている薬に対して、引き続き安全性や適切な使用法などを検討するための臨床試験です。
市販後臨床試験ともよばれ、臨床試験の第四相試験(フェーズ4)にあたります。
厚生労働省による審査が再び行われ、効果が確認出来なかった場合には承認が取り消される場合もあるのです。
販売前の臨床試験では得られなかった情報を収集するため、加えてそもそも医薬品の有効性や安全性を確認を目的として実施されます。対応する法規は以下の通り
・GPSP(製造販売後調査・試験の実施の基準)
・GVP(製造販売後安全管理の基準)


![[Amazon限定ブランド] 医薬品 PHARMA CHOICE 評判は?オリジナルブランドの品質は?なぜ安い??この薬は買っても大丈夫なのか疑問や不安、メリットを徹底解説!!](https://solo-phramacist.com/wp-content/uploads/2021/05/christian-wiediger-rymh7EZPqRs-unsplash-375x250.jpg)


